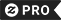Tryck/klicka på bilden för att se fler RealViewsTM
283,00 kr
per tröja
im inte lat I har precis inte nog enzym T-shirt
Antal:
Style
Basic T-Shirt för kvinnor
+110,00 kr
+275,00 kr
+120,00 kr
Färg och tryckprocess
Vit
Klassisk tryck med ingen bas färg
Vibrant tryck över vit bas färg
+70,00 kr
+70,00 kr
+70,00 kr
+70,00 kr
+70,00 kr
+70,00 kr
+70,00 kr
Om T-tröjor
Såld av
Om denna design
im inte lat I har precis inte nog enzym T-shirt
Enzym är proteiner som catalyze (dvs., förhöjning klassar av) kemiska reaktioner. [1] [2] i enzymatic reaktioner, molekylarna på början av behandlingen kallas substrates, och enzymet konverterar dem in i olika molekylar som kallas produkterna. Nästan allt bearbetar i biologiska enzym för ett cellbehov för att uppstå på viktigt klassar. Sedan enzym är selektiva för deras substrates och rusar upp endast några reaktioner från bland många möjligheter, bestämmer uppsättningen av enzym som göras i en cell, vilka metabolic banor uppstår däri cellen. Gilla alla katalysatorer, enzym fungerar, genom att fälla ned aktiveringsenergin (Ea-‡) för en reaktion, således dramatiskt ökande klassa av reaktionen. Som ett resultat bildas produkter snabbare, och reaktioner ner deras equilibrium påstår snabbare. Mest enzymreaktion klassar är miljoner av tider snabbare än de av jämförbara un-catalyzed reaktioner. Som med alla katalysatorer, konsumeras enzym inte av reaktionerna som de catalyze, nor förändrar de equilibriumen av dessa reaktioner. Emellertid skilja sig åt enzym från mest andra katalysatorer genom att vara mycket mer specifik. Enzym är bekant att catalyze omkring 4.000 biochemical reaktioner. [3] Några RNAmolekylar som kallas ribozymes catalyze också, reaktioner, med viktigt exempel som ett är några delar av ribosomen. [4] [5] syntetmaterialmolekylar kallade konstgjorda enzym visar också enzym-något liknande catalysis. [6] Enzymaktivitet kan påverkas av andra molekylar. Inhibitors är molekylar den minskningenzymaktivitet; activators är molekylar den förhöjningaktivitet. Många droger och gifter är enzyminhibitors. Aktivitet påverkas också av temperatur, den kemiska miljön (e.g., pH) och koncentrationen av substraten. Några enzym används kommersiellt, till exempel, i syntesen av antibiotikummar. I tillägg använder några hushållprodukter enzym för att rusa upp biochemical reaktioner (e.g., enzym i biologisk tvagning pudrar avbrottet besegrar protein- eller tjockfläckar på kläder; enzym i kötttenderizersavbrott besegrar proteiner, danande köttet som är lättare att tugga). Innehåll [skinn] 1 Etymology och historia 2 strukturerar, och noggrannhet 2.1.1" för mekanism 2,1 låser, och nyckeln" modellerar 2,2 mekanism 2.2.1 dynamik för stabilisering 2.2.2 för övergång statliga och fungerar 2,3 Allosteric Cofactors för modulering 3, och coenzymes 3,1 Cofactors 3,2 Coenzymes 4 biologisk hämning 7 för Kinetics som 6 för Thermodynamics 5 fungerar 8, kontrollerar av medverkan för aktivitet 9 i namnge reglar för sjukdom 10 11 industriella applikationer 12 ser att också 13 hänvisar till 14 mer ytterligare utsida för läsning 15 anknyter [redigera] Etymology och den historie Eduard BuchnerAs tidigt som sen 18th och 19th århundraden för tidigt, matsmältningen av kött vid magesecretions [7] och omvandlingen av stärkelse till sockrar vid växtextrakt och saliva var bekant. Emellertid hade mekanismen, som denna uppstod vid, inte identifierats. [8] I det 19th århundradet, när han studerade jäsningen av socker till alkohol vid jäst, Louis Pasteur kom till avslutningen att denna jäsning catalyzed av en livsviktig styrka som innehölls inom jästcellerna som kallades "jäsningar", som tänktes för att fungera endast inom bosatt organismer. Han skrev att "alkoholiserad jäsning är en agera som korreleras med livet och organisationen av jästcellerna, inte med döden eller putrefactionen av cellerna. " [9] i 1877, använde den tyska physiologisten Wilhelm Kühne (1837-1900) först benämnaenzymet, som kommer från ενζυμον, "i leaven", för att beskriva denna behandling. [10] Ordenzymet var använd mer sistnämnd som ser till nonliving vikter liksom pepsin, och ordjäsningen var van vid ser till kemisk aktivitet som producerades av uppehälleorganismer. I 1897 sände Eduard Buchner hans första papper på kapaciteten av jästextrakt som saknade några bosatt jästceller för att jäsa socker. I en serie av experiment på av Berlin grundar han att sockret jästes, även om det inte fanns några bosatt jästceller i blandningen. [11] Han namngav enzymet som kom med om jäsningen av sucrose "zymase". [12] I 1907 mottog han den Nobel prisen i kemi "för hans biochemical forskning och hans upptäckt av cell-fri jäsning". Efter Buchners namnges exempel, enzym vanligt enligt reaktionen som de bär ut. Typisk att frambringa namn av ett enzym ändelsen - ase tillfogas till namn av dess substrate (e.g., är lactase enzymet som klyver lactose), eller typen av reaktion (e.g., DNA-polymerasen bildar DNA-polymrer). [13] Efter att ha visat, att enzym kunde fungera utanför en bosatt cell, kliver de nästa var att bestämma deras biochemical natur. Många tidiga arbetare noterade att enzymatic aktivitet var tillhörande med proteiner, men flera forskare (liksom den Nobel laureaten Richard Willstätter) argumenterade att proteiner var bara bärare för de riktiga enzymen och att proteiner per se var inkompetenta av catalysis. Emellertid i 1926, visade James B. Sumner att enzymureasen var ett rent protein och kristalliserat det; Sumner gjorde jämväl för enzymcatalasen i 1937. Avslutningen, att rena proteiner kan vara enzym, bevisades definitively av Northrop och Stanley, som fungerade på digestivkexenzympepsinen (1930), trypsin och chymotrypsin. Dessa tre forskare tilldelades den Nobel prisen 1946 i kemi. [14] Denna upptäckt, att enzym kunde vara kristalliserade slutligen tillåtna deras, strukturerar för att lösas av röntgenstrålecrystallography. Denna var först förlorad lysozyme, ett enzym som fanns i tårar, saliva och äggvitar som smälter beläggningen av några bakterier; strukturera löstes av en grupp ledde vid David Chilton Phillips och publicerade i 1965. [15] Detta med hög upplösning strukturerar av lysozyme markerade början av fält av strukturell biologi, och försöket att förstå, hur enzym fungerar på ett atom-, jämnar av specificerar. [redigera], strukturerar, och mekanismen ser också: Anhydrase II. för människa för visning för diagram för enzymcatalysisband carbonic. Grå färgspheren är zinccofactoren i aktivplatsen. Diagram utdraget från PDB 1MOO.Enzymes är allmänt klotformiga proteiner och spänner från precis 62 amino syrliga rest i format, för monomeren av tautomerasen för 4 oxalocrotonate, [16] till över 2.500 rest i den djura fettsyrasynthasen. [17] Ett litet nummer av RNA-baserade biologiska katalysatorer finns, med den mest allmänningen som är ribosomen; dessa ses till som endera RNA-enzym eller ribozymes. Aktiviteterna av enzym är beslutsamma vid deras tredimensionellt strukturerar. [18] Emellertid även om strukturera, bestämmer fungerar, förutsägelsen som nya ett enzym aktivitet från dess strukturerar precis är ett mycket svårt problem, som inte har ännu lösts. [19] Mest enzym är mycket större än substratesna som de agerar på, och endast portionr ett litet av enzymet (omkring 3-4 amino syror) är direkt involverat i catalysis. [20] Regionen, som innehåller dessa katalytiska rest, röror substraten, och därefter, bär reaktionen är ut bekant som aktivplatsen. Enzym kan också innehålla platser som röracofactors, som är nödvändiga för catalysis. Några enzym har också bindande platser för lilla molekylar, som är riktar ofta eller indirekta produkter eller substrates av den catalyzed reaktionen. Detta band kan tjäna som till förhöjning eller minskning enzym aktivitet, att ge elak för återkopplingsreglering. Gilla alla proteiner, enzym är långt, linjärt kedjar av amino syror som viker till jordbruksprodukter en tredimensionell produkt. Varje unik amino syra ordnar producerar en närmare detalj strukturerar, som har unika egendomar. Individen som protein kedjar, kan ibland gruppera tillsammans för att bilda ett proteinkomplex. Mest enzym kan vara denatured-att är, uppvecklat och inactivated-vid uppvärmning eller kemiska denaturants, som avbryter det tredimensionellt, strukturera av proteinet. Beroende av enzymet kan denaturation vara vändbar eller irreversible. Strukturerar av enzym i komplex med substrates, eller substratemotsvarigheter under en reaktion kan erhållas genom att använda Time löste crystallographymetoder. [redigera], är noggrannhetenzym vanligt mycket specifika om vilka reaktioner de catalyze och substratesna som är involverade i dessa reaktioner. Kompletterande forma, laddningen, och hydrophilic/hydrophobic kännetecken av enzym och substrates är ansvariga för denna noggrannhet. Enzym kan också visa att mäktigt jämnar av stereospecificity, regioselectivity och chemoselectivity. [21] Någon av enzymvisningen den högsta noggrannheten och exaktheten är involverad i kopiera och uttryckt av genom. Dessa enzym har "motståndskraftig-läsning" mekanism. Här catalyzes ett enzym liksom DNA-polymerasen en reaktion i en första steg, och därefter kliver kontroller, att produkten är korrekt i en understödja. [22] Detta två-kliver processaa resultat i genomsnittligt fel klassar av mer mindre än 1 fel i 100 miljon reaktioner i kick-trohet däggdjurs- polymerases. [23] Den liknande korrekturläsa mekanismen finnas också i RNApolymerase, [24] aminoacyltRNAsynthetases [25] och ribosomes. [26] Några enzym, att sekundära metabolites för jordbruksprodukter beskrivas som promiskuösa, som de kan agera på ett förhållandevis brett, spänner av olika substrates. Det har föreslågits att denna breda substratenoggrannhet är viktig för evolutionen av nya biosynthetic banor. [redigera] [27] "låsa, och nyckeln" modellerar enzym är mycket specifik, och den föresloggs av den organiska kemisten Emil Fischer för den Nobel laureaten i 1894 att denna var, därför att både enzymet och substraten äger specifikt kompletterande geometriskt formar den passform exakt in i en another. [28] Detta ses ofta till, som "låsa och nyckeln" modellerar. Emellertid förklarar stunden som denna modellerar, enzymnoggrannheten, det misslyckas för att förklara stabiliseringen av den statliga övergången som enzym uppnår. Diagram som visar den framkallade färdiga hypotesen av enzymhandlingen. I 1958 föreslogg Daniel Koshland att en ändring till låsa och nyckeln modellerar: sedan enzym är ganska böjliga strukturerar, aktivplatsen reshapeds ständigt av växelverkan med substraten, som substraten påverkar varandra med enzymet. [29] Som ett resultat gör substraten inte enkelt röran till en styv aktivplats; den amino syrliga sidan kedjar som sminket som aktivplatsen gjutas in i precisera, placerar, som möjliggör enzymet för att utföra dess katalytiskt fungerar. I vissa fall liksom glycosidases, formar ändringarna för substratemolekylen också litet, som det skriver in aktivplatsen. [30] Aktivplatsen fortsätter för att ändra, tills substraten är fullständigt destinerad, som peka på finalen formar, och laddningen är beslutsam. [31] Den framkallade passformen kan förhöja troheten av molekylär erkännande i närvaroen av konkurrens och stoja via den conformational korrekturläsa mekanismen. [redigera] [32] mekanismenzym kan agera i flera väg, som fäller ned ΔG-‡: [33] När du fäller ned aktiveringsenergin, genom att skapa en miljö, som den statliga övergången stabiliseras i (anstränga e.g. forma av a substrate-vid bandet denstatliga gestaltningen av de substrate-/produktmolekylarna, enzymet, förvrider de destinerade substratena in i deras statliga övergång bildar, därmed förminskande beloppet av energi som krävs för att avsluta övergången). Fälla ned energin av övergången som är statlig, men, utan förvridning av substraten, genom att skapa en miljö med motsatsladdningsfördelningen till det av den statliga övergången. Ge en alternativ bana. Till exempel tillfälligt omöjligt det är att reagera med substraten för att bilda ett mellanliggande ES-komplex, som skulle, i frånvaroen av enzymet. Förminskande reaktionsentropiändringen, genom att komma med substrates tillsammans i den korrekta riktningen för att reagera. Betrakta ΔH-‡ ensam förbiser detta verkställer. Förhöjningar i temperaturer rusar upp reaktioner. Således temperaturförhöjninghjälp som enzymet fungerar och framkallar avslutaprodukten även snabbare. Emellertid, om upphettat, formar för mycket, enzymet försämras och när endast temperaturen kommer tillbaka till det normala, gör den dess enzymåterkomsten formar. Enzym för något liknande för några enzym fungerar thermolabile bäst på låga temperaturer. Interestingly verkställer detta entropic gäller destabilization av det slipat påstår, [34], och dess bidrag till catalysisen är förhållandevis litet. [redigera] [35] statlig stabilisering för övergången överenskommelsen av ursprung av förminskningen av ΔG-‡ kräver en att finna ut hur enzymen kan stabilisera dess övergång påstår mer än övergången som är statlig av den uncatalyzed reaktionen. Som synes är det effektivast långt för neende stor stabilisering användan av elektrostatiskt verkställer, i synnerhet, genom att ha en förhållandevis fixad polar miljö som orienteras in mot laddningsfördelningen av den statliga övergången. [36] En sådan miljö finns inte i den uncatalyzed reaktionen i vatten. [redigera], fungerar dynamik och ser också: Proteindynamik den inre dynamiken av enzym anknytas till deras mekanism av catalysisen. [37] [38] [är 39] inre dynamik rörelsen av delar av enzymet strukturerar, liksom amino syrliga rest för individ, en grupp av amino syror eller även ett helt proteinområde. Dessa förehavanden uppstår på olika Time-fjäll som spänner från femtoseconds, understöder. Knyter kontakt av proteinrestalltigenom som ett enzym strukturerar kan bidra till catalysisen till och med dynamiska rörelser. [40] [41] [42] [är fastar 43,] proteinrörelser livsviktiga till många enzym, men huruvida lilla och vibrationer, eller större och långsammare conformational förehavanden är viktigare beror på den involverade typen av reaktion. Emellertid även om dessa förehavanden är viktig i band och frigörasubstrates och produkter, är den inte klar, om proteinförehavanden hjälper att accelerera det kemiskt kliver i enzymatic reaktioner. [44] Dessa nya inblickar har också implikationer i allosteric överenskommelse verkställer och framkallande nya droger. [redigera], den Allosteric övergången för Allosteric modulering av ett enzym mellan r- och T-stater som stabiliseras av en agonist, en inhibitor och en huvudsaklig artikel för substrate (MWCNA modellerar): Är Allosteric platser för Allosteric reglering platser på enzymet den röra till molekylar i den cell- miljön. Platserna bildar svaga noncovalent förbindelser med dessa molekylar och att orsaka en ändring i gestaltningen av enzymet. Denna ändring i gestaltning översätter till aktivplatsen, som påverkar därefter reaktionen klassar av enzymet. [45] Allosteric växelverkan kan både förhindra och aktivera enzym och är en allmänning långt att enzym kontrolleras i förkroppsliga. [redigera] [46] huvudsakliga artiklar för Cofactors och för coenzymes: Cofactors för Cofactor (biochemistry) och för Coenzyme [redigera], några enzym behöver inte några extra delar att visa full aktivitet. Emellertid kräver andra non-protein molekylar som kallas cofactors att vara destinerade för aktivitet. [47] Cofactors kan vara endera oorganiska (e.g., samla i en klunga det metalljoner och järn-svavel) eller organiska sammansättningar (e.g., flavinen och heme). Organiska cofactors kan vara endera prosthetic grupper, som är stramt destinerade till ett enzym, eller coenzymes, som är utsläppt från enzym aktivplatsen under reaktionen. Coenzymes inkluderar NADH, NADPH och adenosinetriphosphaten. Dessa molekylar överför kemiska grupper mellan enzym. [48] Ett exempel av ett enzym, som innehåller en cofactor, är den carbonic anhydrasen och visas i banddiagrammet över med en zinccofactor som är destinerad som del av dess aktivplats. [49] Dessa stramt destinerade molekylar finnas i aktivplatsen och är vanligt involverade i catalysis. Till exempel är flavinen och hemecofactors ofta involverade i redoxreaktioner. Enzym, som kräver en cofactor men, har inte destinerad en kallas apoenzymes eller apoproteins. En apoenzyme samman med dess cofactor kallas en holoenzyme (denna är aktivet bildar). Mest cofactors fästas inte covalently till ett enzym, utan är mycket stramt destinerade. Emellertid kan organiska prosthetic grupper vara covalently destinerade (e.g., thiaminepyrophosphaten i enzympyruvatedehydrogenasen). Benämna "holoenzyme" kan också appliceras till enzym, som innehåller åtskilliga proteinsubunits, liksom DNA-polymerasesna; här är holoenzymen det färdiga komplex som innehåller alla subunits som behövs för aktivitet. [redigera], är Coenzymes som Utrymme-fyllning modellerar av coenzymen NADHCoenzymes, lilla organiska molekylar som transporterar kemiska grupper från ett enzym till another. [50] Några av dessa kemikalieer liksom riboflavin, thiamine och folsyra är vitaminer (sammansättningar som inte kan synthesizeds av förkroppsliga och måste fås från banta). De burna kemiska grupperna inkluderar hydridejonen (H) som bärs av NAD eller NADP+, bar phosphategruppen vid adenosinetriphosphaten, acetylgruppen som bars av coenzyme A, formyl, methenyl eller methyl grupper som bars av folsyra, och den methyl gruppen som bars av S-adenosylmethionine. Sedan coenzymes ändras chemically som en följd av enzymhandlingen, är den användbar att betrakta coenzymes för att vara en sakkunnig klassificerar av substrates eller understöder substrates, som är vanligt till många olika enzym. Till exempel är omkring 700 enzym bekant att använda coenzymen NADH. [51] Coenzymes vanligt fortlöpande regenereras, och deras koncentrationer underhålls på en jämn insida för stödja cellen: till exempel regenereras NADPH till och med den pentosephosphatebanan och Sen-adenosylmethionine av methionineadenosyltransferase. Denna fortlöpande regeneration betyder att även lilla belopp av coenzymes används mycket intensivt. Till exempel vänder människokroppen över dess eget väger i ATP varje dag. [redigera] [52] Thermodynamics som energierna av arrangerar av en kemisk reaktion. Substrates behöver en raddaenergi att ne en statlig övergång, som förfaller därefter in i produkter. Enzymet stabiliserar den statliga övergången, förminskande energin som behövs för att bilda produkter. Huvudsakliga artiklar: Aktiveringsenergi, Thermodynamic equilibrium och kemisk equilibrium som alla katalysatorer, enzym förändrar inte placera av den kemiska equilibriumen av reaktionen. Vanligt i närvaroen av ett enzym, kör reaktionen i den samma riktningen, som den skulle utan enzymet, precis snabbare. Emellertid i frånvaroen av enzymet, uncatalyzed annan möjlighet, "den spontana" reaktionsstyrkan som var bly- till olika produkter, därför att i de villkor denna olika produkt bildas snabbare. Dessutom, kan enzym koppla ihop två eller mer reaktioner, så att en thermodynamically gynnsam reaktion kan vara van vid "drev" thermodynamically unfavorable. Till exempel är hydrolysisen av ATP ofta van vid drev andra kemiska reaktioner. [53] Enzym catalyze de framåt och bakåtriktade reaktionerna lika. De förändrar inte equilibriumen sig själv, utan endast rusa som den nes på. Till exempel catalyzes den carbonic anhydrasen dess reaktion i antingen riktning beroende av koncentrationen av dess personer som reagerar. (i silkespapper; kickCO2koncentration) (i lungs; låg CO2koncentration) ändå, om equilibriumen förflyttas väldeliga i en riktning, dvs., i en mycket exergonic reaktion, reaktionen är effektivt irreversible. Under dessa villkor catalyze enzymet som ska, i faktum, endast reaktionen i den thermodynamically tillåtna riktningen. [redigera], den huvudsakliga artikeln för Kinetics: Enzymkinetics mekanismen för ett singelsubstrateenzym catalyzed reaktion. Rörorna för enzym (E) en substrate (S) och producerar en produkt (P). Enzymkinetics är utredningen av hur enzymrörasubstrates och vänder dem in i produkter. Klassadatan som används i kinetic analyser, erhålls från enzymanalyser. I victoren 1902 föreslagna Henri [54] var en kvantitativ teori av enzymkinetics, bara hans experimentella data inte användbar, därför att signifikansen av vätejonkoncentrationen inte uppskattades ännu. Efter Peter Lauritz Sørensen hade definierat det logaritmiska pH-fjäll, och introducerat begreppet av att fungera som buffert i 1909 [55] upprepade bekräftade den tyska kemisten Leonor Michaelis och hans kanadensiska postdoc Maud Leonora Menten Henris experiment och hans likställande som ses till som Henri-Michaelis-Menten kinetics (ibland också Michaelis-Menten kinetics). [56] Deras arbete framkallades vidare av G.E. Briggs och J.B.S. Haldane, som härledde kinetic likställande, som är stilla som brett i dag används. [57] Ha som huvudämnebidraget av Henri var att tänka av enzymreaktioner arrangerar itu. I första substraterörorna vändbart till enzymet som bildar detsubstrate komplex. Detta kallas ibland det Michaelis komplex. Enzymet catalyzes därefter det kemiskt kliver i reaktionen och frigörarna produkten. Saturation buktar för en enzymreaktionsvisning förhållandet mellan substratekoncentrationen (S) och klassar (v). Enzym kan catalyze flera miljon reaktioner per understöder upp till. Till exempel den uncatalyzed decarboxylationen av orotidine 5' - monophosphaten har ett halveringstit av 78 miljon år. Emellertid när enzymorotidinen 5' - phosphatedecarboxylasen tillfogas, den samma behandlingen tar precis 25 millisekunder. [58] Enzymet klassar beror på lösningsvillkor och substratekoncentration. Villkor, som denature proteinet, avskaffar enzymaktivitet, liksom höga temperaturer, ytterligheter av pH eller salt koncentrationer för kick, stunder som lyfter substratekoncentration, ansar till förhöjningaktivitet. Att finna maximat rusa av en enzymatic reaktion, substratekoncentrationen ökas, tills en konstant klassar av produktbildande ses. Detta visas i saturationen buktar på höger. Saturation händer, därför att, som substratekoncentrationsförhöjningar, mer och mer av det fria enzymet konverteras in i dendestinerade ESEN bildar. På maximat hastighet (Vmax) av enzymet, är alla enzymaktivplatser destinerade till substraten, och beloppet av ES-komplex är samma som det sammanlagda beloppet av enzym. Emellertid är Vmax endast en kinetic konstant av enzym. Beloppet av substrate som behövs för att uppnå given, klassar av reaktion är också viktigt. Detta ges av den Michaelis-Menten konstanten (Km), som är substratekoncentrationen som krävs för att ett enzym ska ne en-halva dess maximum hastighet. Varje enzym har ett kännetecken Km för en given substrate, och detta kan visa hur tätt bandet av substraten är till enzymet. En annan användbar konstant är kcat, som är numrera av substratemolekylar som behandlas av en aktivplats per, understöder. Effektiviteten av ett enzym kan uttryckas in benämner av kcat/Km. Alla detta kallas noggrannhetkonstanten och också inkorporerar klassakonstanterna för kliver i reaktionen. Därför att noggrannhetkonstanten reflekterar både frändskap och katalytisk kapacitet, är den användbar för att jämföra olika enzym mot varje annan eller det samma enzymet med olika substrates. Det teoretiska maximat för noggrannhetkonstanten kallas diffusionen begränsar och är omkring 108 till 109 (M−1 s−1). På detta peka varje sammanstötning av enzymet med dess substraten ska resultat i catalysis, och klassa av produktbildande begränsas inte av reaktionen klassar, men vid diffusionen klassa. Enzym med denna egendom kallas catalytically perfekta eller kinetically perfekten. Exemplet av sådan enzym är denphosphate isomerasen, den carbonic anhydrasen, acetylcholinesterasen, catalasen, fumarase, βen-lactamase och superoxidedismutase. Michaelis-Menten kinetics relies på lagen av samlas handlingen, som härledas från antagandena av fri diffusion och thermodynamically den drivande slumpmässiga sammanstötningen. Emellertid bearbetar många biochemical eller cell- avviker markant från dessa villkor, på grund av macromolecular trängsel, arrangera gradvisavskiljandet av enzymet/substraten/produkten, eller en eller tvådimensionell molekylär rörelse. [59] I dessa lägen kan en fractalMichaelis-Menten kinetics appliceras. [60] [61] [62] [fungerar 63,] några enzym med kinetics som är snabbare, än diffusion klassar, som skulle verkar för att vara omöjlig. Flera mekanism har åkallats för att förklara detta fenomen. Några proteiner tros för att accelerera catalysis, genom att dra deras substrate in och pre-att orientera dem, genom att använda dipolar elkraftfält. Annat modellerar åkallar enmekanisk grävaförklaring, whereby en proton eller en elektron kan gräva till och med aktiveringsbarriärer, även om för protonen som gräver denna, modellera återstår något kontroversiellt. [64] [65] Quantum som gräver för protons, har observerats i tryptamine. [66] Detta föreslår att enzymcatalysisen kan exaktare karakteriseras, som "till och med barriären" ganska än de traditionella modellerar, som kräver substrates att gå "över" en fälld ned energibarriär. [redigera], den konkurrenskraftiga inhibitorsröran för hämning vändbart till enzymet som förhindrar bandet av substraten. Å andra sidan förhindrar bandet av substraten bandet av inhibitoren. Substraten och inhibitoren konkurrerar för enzymet. Typer av hämning. Denna klassifikation introducerades av W.W. Cleland. [67] Huvudsaklig artikel: Reaktion för enzyminhibitorenzymet klassar kan minskas av olika typer av enzyminhibitors. Konkurrenskraftig hämning i konkurrenskraftig hämning, inhibitoren och substraten konkurrerar för enzymet (, de dvs. kan inte röran samtidigt). [68] Ofta konkurrenskraftiga inhibitors liknar starkt den verkliga substraten av enzymet. Till exempel är methotrexate en konkurrenskraftig inhibitor av enzymdihydrofolatereductasen, som catalyzes förminskningen av dihydrofolate till tetrahydrofolate. Likheten mellan strukturerar av folsyra, och denna drog visas i figuren till den högra grunden. Notera att bandet av inhibitoren inte behöver att vara till den bindande platsen för substraten (som vanligt påstått), om bandet av inhibitoren ändrar gestaltningen av enzymet för att förhindra substratebandet och omvänt. I konkurrenskraftig hämning ändras den maximala hastigheten av reaktionen inte, men högre substratekoncentrationer krävs för att ne en given hastighet som är ökande den påtagliga Kmen. Uncompetitive hämning i uncompetitive hämning inhibitoren kan inte röran till det fria enzymet, utan endast till ES-komplex. EIS-komplex som bildas thus, är enzymatically inaktivt. Denna typ av hämning är sällsynt, men kan uppstå i multimeric enzym. på burk Non-konkurrenskraftiga inhibitors för Non-konkurrenskraftig hämning röra till enzymet samtidigt som substraten, dem dvs. aldrig röran till aktivplatsen. Både EI- och EIS-komplexen är enzymatically inaktiva. Därför att inhibitoren inte kan vara drivande från enzymet vid högre substratekoncentration (i kontrast till konkurrenskraftig hämning), ändrar den påtagliga Vmaxen. Men, därför att substraten kan stilla röra till enzymet, Km-stagen samma. Blandad hämning denna typ av hämning liknar detkonkurrenskraftigt, undantar att EIS-komplex har resterande enzymatic aktivitet. I många organisminhibitors kan agera som del av en återkopplingsmekanism. Om ett enzym producerar för mycket av en vikt i organismen, kan den vikt agera som en inhibitor för enzymet på början av banan, som producerar den och att orsaka produktionen av vikten för att sakta besegrar eller stoppar, när det finns det tillräckliga beloppet. Denna är en bilda av negativ återkoppling. Enzym, som är subjekt till detta, bildar av reglering är ofta multimeric och har allosteric bindande platser för reglerande vikter. Deras är substraten/hastighetstäppor inte hyperbolar, utan sigmoidal (S-format).
Automatisk översättning
Store
Kundrecensioner
4.7 av 5 stjärnor betyg12 totalt antal recensioner
12 Recensioner
Recensioner för liknande produkter
5 av 5 stjärnor betyg
Av Lisa B.8 mars 2017 • Verifierat köp
Basic T-Shirt för kvinnor, Vit, Vuxen L
Zazzles program för granskare
Så enkelt att fylla i sin egen information och få t-shirten precis som man önskar! Jag är jättenöjd =). Såg ut precis som bilden, kunde inte varit mer nöjd - tack Zazzle!
5 av 5 stjärnor betyg
Av Susanne H.3 augusti 2017 • Verifierat köp
Bella+Canvas Slim Fit T-shirt för kvinnor, Svart, Vuxen L
Zazzles program för granskare
Toppensnygg T-shirt i hög kvalitet. Bra passform och fint tryck. Rekommenderas! Mycket fina färger som behåller sin colorit efter tvätt.
5 av 5 stjärnor betyg
Av Lena A.13 december 2022 • Verifierat köp
Bella+Canvas Slim Fit T-shirt för kvinnor, Kelly Grönt, Vuxen L
Zazzles program för granskare
Fin t-shirt med julmotiv och med bra kvalitet. Fint tomtetryck i bra färg
Taggar
Annan information
Produkt ID: 235136738702665944
Skapad: 2010-10-11 22:07
Betyg: G
Nyligen besökta produkter